PRODUITS
Nos Produits
En conformité avec l’article L.5121-1-3 du code de la santé publique, ci-après la liste des principes actifs des médicaments pour lesquels Nordic Pharma assure la commercialisation.
Ci-après également la liste des dispositifs médicaux pour lesquels Nordic Pharma assure la distribution.

Rhumatologie
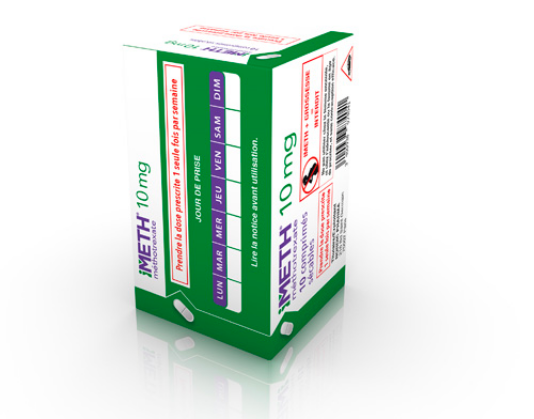
iMETH® 10 mg, comprimé sécable / DCI* : méthotrexate
iMETH® 10 mg, comprimé sécable / DCI* : méthotrexate
- Méthotrexate
- Boîte de 10
Prendre la dose prescrite une seule fois par semaine.
Commercialisé en novembre 2010.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/60819417/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Modalités de prise des comprimés de méthotrexate – Document d’information patients
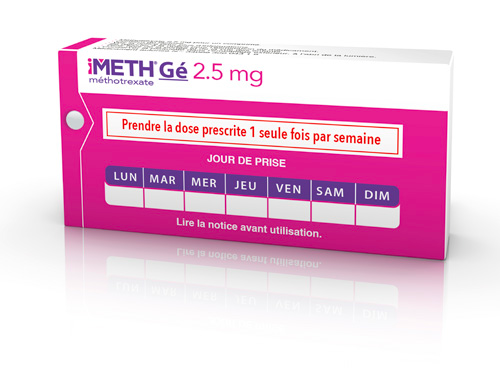
iMETH® Gé 2,5 mg, comprimé / DCI* : méthotrexate
iMETH® Gé 2,5 mg, comprimé / DCI* : méthotrexate
- Méthotrexate
- Boîte de 24
Prendre la dose prescrite une seule fois par semaine.
Commercialisé en janvier 2013.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/61495968/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Modalités de prise des comprimés de méthotrexate – Document d’information patients
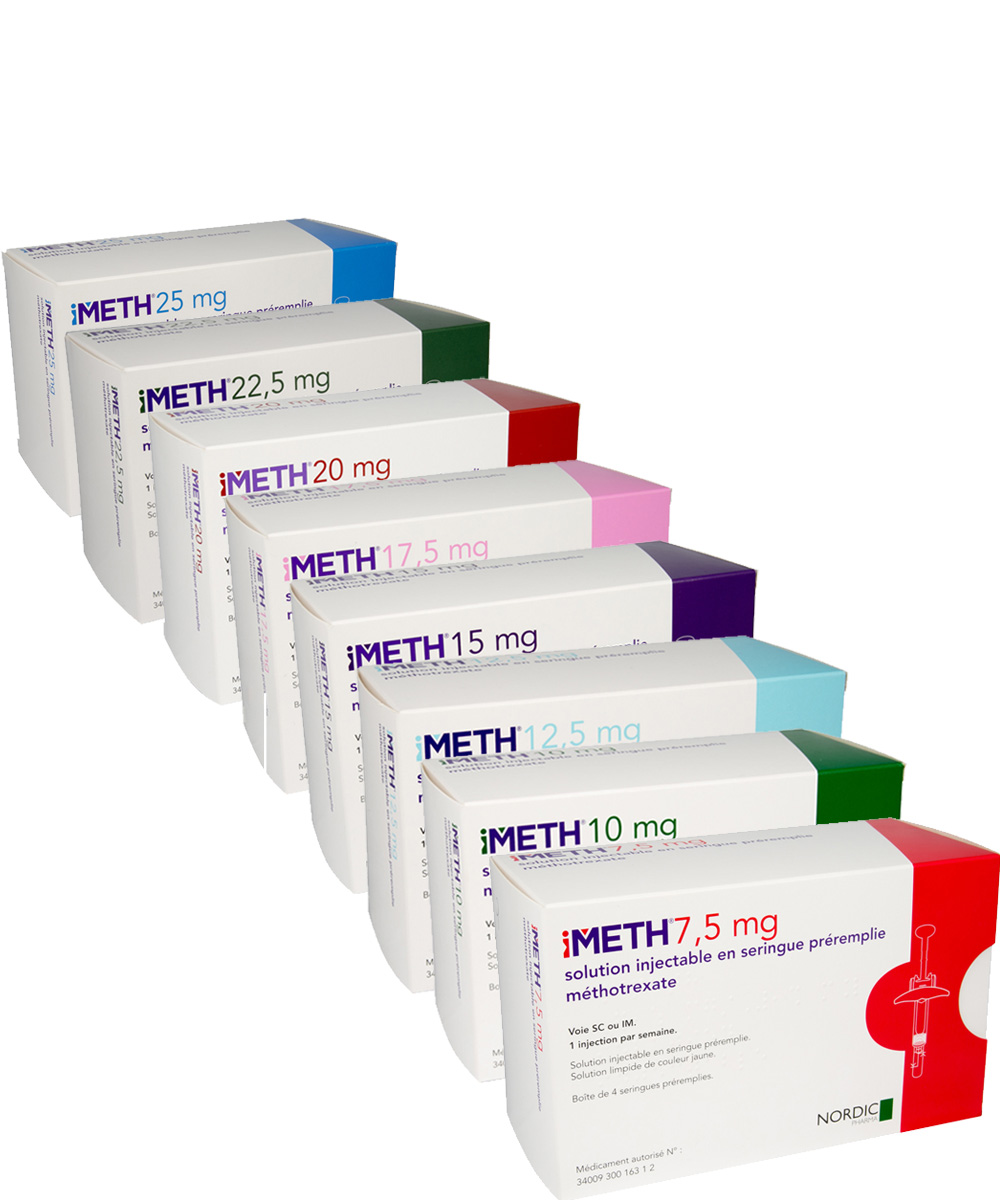
iMETH® solution injectable en seringue préremplie / DCI* : méthotrexate
iMETH® solution injectable en seringue préremplie / DCI* : méthotrexate
- Méthotrexate
- Seringue préremplie de 0,3 ml à 1 ml
- 8 dosages :
- iMETH® 7,5 mg / 0,3 ml
- iMETH® 10 mg / 0,4 ml
- iMETH® 12,5 mg / 0,5 ml
- iMETH® 15 mg / 0,6 ml
- iMETH® 17,5 mg / 0,7 ml
- iMETH® 20 mg / 0,8 ml
- iMETH® 22,5 mg / 0,9 ml
- iMETH® 25 mg / ml
1 injection par semaine.
Commercialisé en avril 2016.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/65415275/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Instructions pour l’injection – Document d’information patients
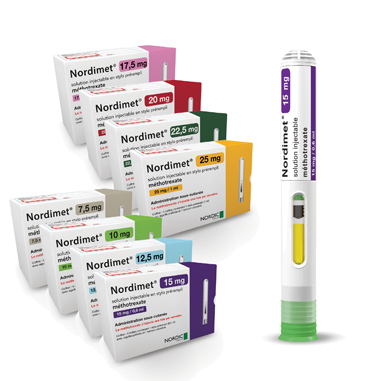
NORDiMET® solution injectable en stylo prérempli / DCI* : méthotrexate
NORDiMET® solution injectable en stylo prérempli / DCI* : méthotrexate
- Méthotrexate
- Stylo prérempli de 0,3 ml à 1 ml
- 8 dosages :
- NORDiMET® 7,5 mg / 0,3 ml
- NORDiMET® 10 mg / 0,4 ml
- NORDiMET® 12,5 mg / 0,5 ml
- NORDiMET® 15 mg / 0,6 ml
- NORDiMET® 17,5 mg / 0,7 ml
- NORDiMET® 20 mg / 0,8 ml
- NORDiMET® 22,5 mg / 0,9 ml
- NORDiMET® 25 mg / ml
1 injection par semaine.
Commercialisé en mars 2017.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/67311325/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Instructions pour l’injection – Document d’information patients
iMENOR® 10 mg, comprimé sécable/ DCI* : méthotrexate
iMENOR® 10 mg, comprimé sécable/ DCI* : méthotrexate
- Méthotrexate
- Boîte de 10
Prendre la dose prescrite une seule fois par semaine.
Commercialisé en décembre 2023.

Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/65787731/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Lettre d’information destinée aux professionnels de santé
Brochure destinée aux professionnels de santé
Modalités de prise des comprimés de méthotrexate – Document d’information patients
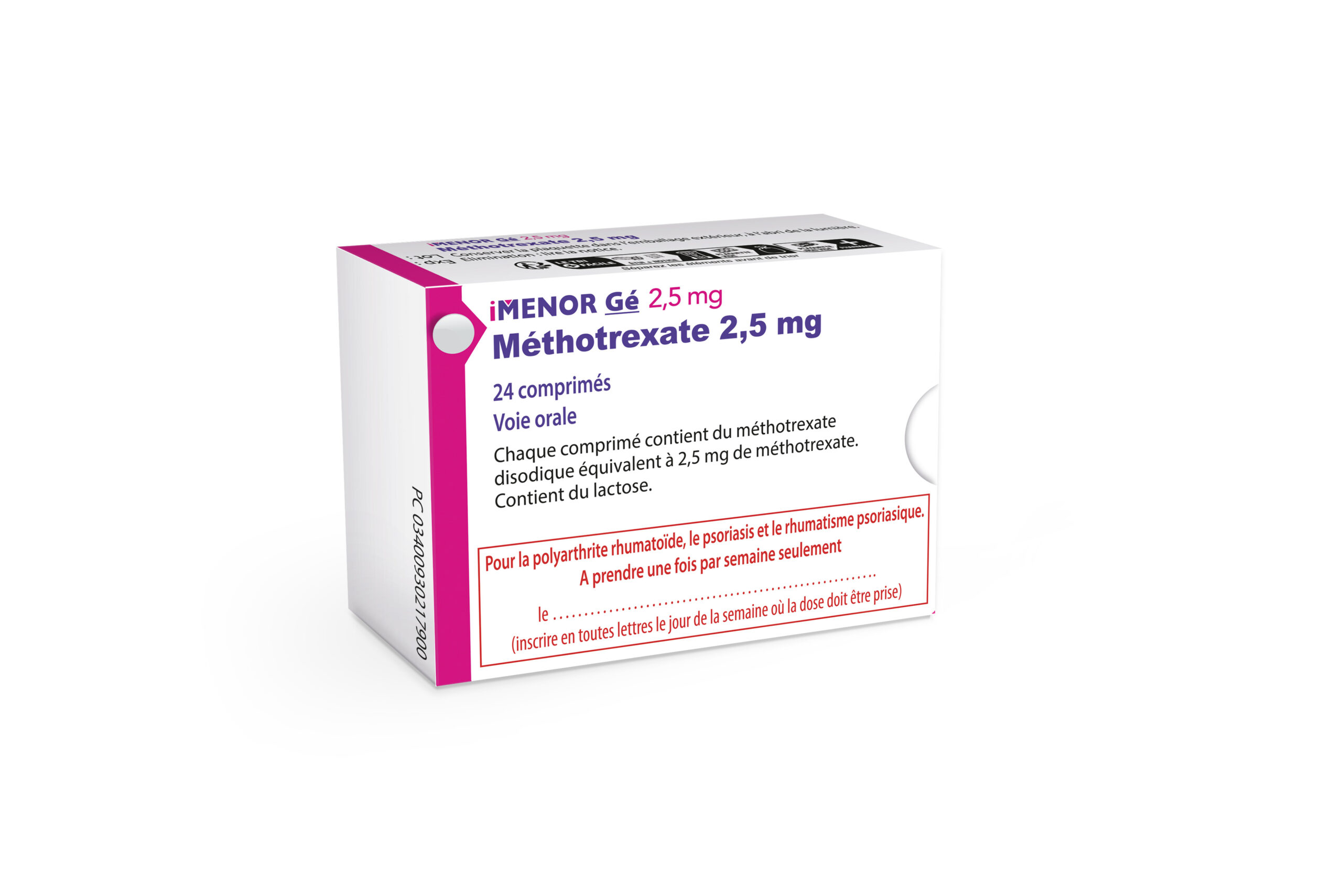
iMENOR® Gé 2,5 mg, comprimé / DCI* : méthotrexate
iMENOR® Gé 2,5 mg, comprimé / DCI* : méthotrexate
- Méthotrexate
- Boîte de 24
Prendre la dose prescrite une seule fois par semaine.
Commercialisé en décembre 2023.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/67791835/extrait
Résumé des caractéristiques du produit
Notice
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Lettre d’information destinée aux professionnels de santé
Brochure destinée aux professionnels de santé
Modalités de prise des comprimés de méthotrexate – Document d’information patients
Gynécologie
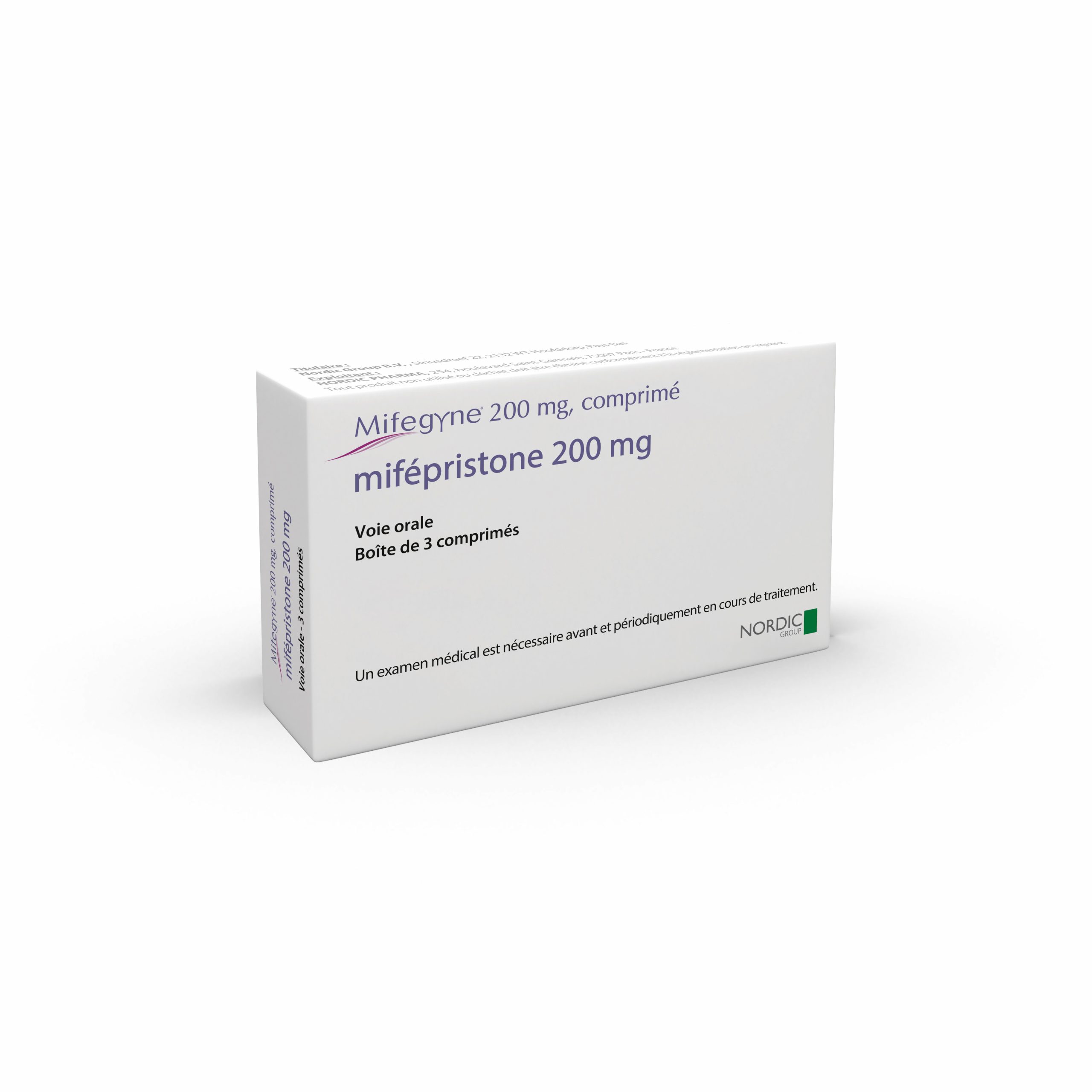
Mifegyne® 200 mg, comprimé / DCI* : mifépristone
Mifegyne® 200 mg, comprimé / DCI* : mifépristone
- Mifépristone
- Comprimé à 200 mg en blister
- Boîte de 3 comprimés
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/66422290/extrait
Résumé des caractéristiques du produit
Notice
Consultez également les documents ci-dessous :
CPC du Misoprostol et Mifépristone dans la prise en charge des Grossesses Arrêtés avant 14 SA
PUT CPC du Misoprostol et Mifépristone dans la prise en charge des GA avant 14 SA
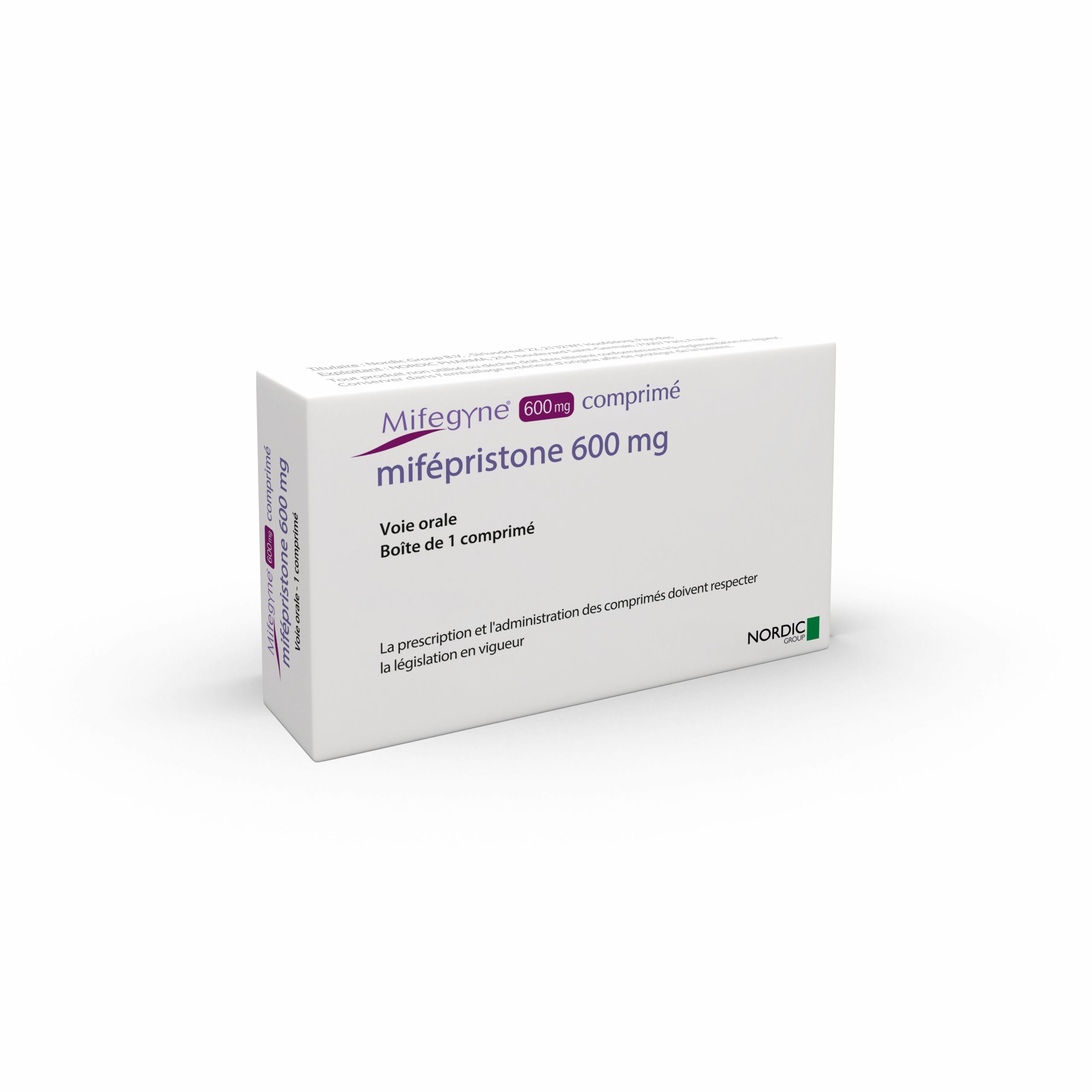
Mifegyne® 600 mg, comprimé / DCI* : mifépristone
Mifegyne® 600 mg, comprimé / DCI* : mifépristone
- Mifépristone
- Comprimé à 600 mg en blister
- Boîte de 1 comprimé
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments,
accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/62681445/extrait
Résumé des caractéristiques du produit
Notice
Consultez également les documents ci-dessous :
CPC du Misoprostol et Mifépristone dans la prise en charge des Grossesses Arrêtés avant 14 SA
PUT CPC du Misoprostol et Mifépristone dans la prise en charge des GA avant 14 SA
Hyalobarrier® gel ACP 200 (auto-crosslinked polysaccharide) ou acide hyaluronique réticulé / Dispositif médical (Gel Endo)
Hyalobarrier® gel ACP 200 (auto-crosslinked polysaccharide) ou acide hyaluronique réticulé / Dispositif médical (Gel Endo)
Prévention ou réduction de la formation des adhérences post-chirurgicales dans la région abdomino-pelvienne.
- Indiqué pour une utilisation en cœlioscopie et hystéroscopie
- Boîte de 2 seringues de 10 ml de gel ACP 200 (3%) et 1 canule de 30 cm
- Boîte de 1 seringue de 10 ml de gel ACP 200 (3%) et 1 canule de 30 cm

Informations sur le produit
La notice est disponible via le lien suivant: :
https://www.nordicpharma.fr/wp-content/uploads/sites/22/2025/11/Notice-Hyalobarrier-2021-11.pdf
Notice
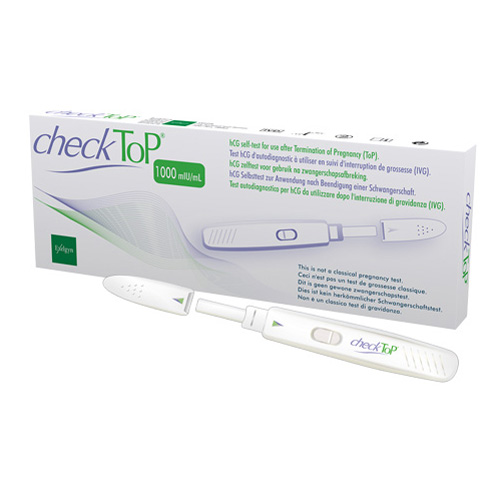
CheckToP® 1 000 mUI/mL / Dispositif médical
CheckToP® 1 000 mUI/mL / Dispositif médical
Test urinaire rapide de basse sensibilité.
Détecte la présence d’un taux de β-hCG dans les urines de 1000 mUI/mL ou plus.
Confirme les interruptions de grossesses intra-utérines jusqu’à 9 semaines d’aménorrhée ainsi que la fausse couche spontanée.
- Boîte unitaire
Commercialisé en décembre 2014.
Informations sur le produit
Le document ci-dessous accessible via le lien suivant :
https://www.nordicpharma.fr/wp-content/uploads/sites/22/2025/03/2024-02-CHECKTOP_PIL.pdf
Notice
MisoOne® 400 µg, comprimé sécable / DCI* : misoprostol
MisoOne® 400 µg, comprimé sécable / DCI* : misoprostol
- Misoprostol
- Comprimé à 400 µg de misoprostol en blister
- Boîte de 1 comprimé
Commercialisé en décembre 2017. - Boîte de 16 comprimés
Commercialisé en janvier 2014.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments, accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/61240145/extrait
Notice
Résumé des caractéristiques du produit
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Document de mesure additionnelle de réduction des risques :
Document destiné aux professionnels de santé
Document destiné aux patientes
CPC du Misoprostol et Mifépristone dans la prise en charge des Grossesses Arrêtés avant 14 SA :
PUT CPC du Misoprostol et Mifépristone dans la prise en charge des GA avant 14 SA
CPC du Misoprostol dans la prise en charge de l’interruption médicale de grossesse et la mort fœtale in utero au delà de 14 SA :
PUT CPC du Misoprostol dans la prise en charge de l’IMG et la MFIU au delà de 14 SA
CPC du Misoprostol dans la prise en charge de l’IVG médicamenteuse aux 8e et 9e SA :
PUT CPC du Misoprostol dans la prise en charge de l’IVG médicamenteuse aux 8e et 9e SA
GYMISO® 200 µg, comprimé / DCI* : misoprostol
GYMISO® 200 µg, comprimé / DCI* : misoprostol
- Misoprostol
- Comprimé à 200 µg de misoprostol en blister
- Boîte de 2 comprimés
Commercialisé en avril 2004.

Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments, accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/69981979/extrait
Notice
Résumé des caractéristiques du produit
Avis de la commission de la transparence
Consultez également les documents ci-dessous :
Document de mesure additionnelle de réduction des risques :
Document destiné aux professionnels de santé
Document destiné aux patientes
CPC du Misoprostol et Mifépristone dans la prise en charge des Grossesses Arrêtés avant 14 SA :
PUT CPC du Misoprostol et Mifépristone dans la prise en charge des GA avant 14 SA
CPC du Misoprostol dans la prise en charge de l’interruption médicale de grossesse et la mort fœtale in utero au delà de 14 SA :
PUT CPC du Misoprostol dans la prise en charge de l’IMG et la MFIU au delà de 14 SA
CPC du Misoprostol dans la prise en charge de l’IVG médicamenteuse aux 8e et 9e SA :
PUT CPC du Misoprostol dans la prise en charge de l’IVG médicamenteuse aux 8e et 9e SA


Anesthésie
Clorotekal® 10 mg/ml, solution injectable / DCI* : chlorhydrate de chloroprocaïne
Clorotekal® 10 mg/ml, solution injectable / DCI* : chlorhydrate de chloroprocaïne
- Chlorhydrate de chloroprocaïne
- Solution injectable
- Boîte de 10 ampoules de 5 ml
Commercialisé en mai 2013.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments, accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/69316926/extrait
Notice
Résumé des caractéristiques du produit
Avis de la commission de la transparence
Baritekal® 20 mg/ml, solution injectable / DCI* : chlorhydrate de prilocaïne
Baritekal® 20 mg/ml, solution injectable / DCI* : chlorhydrate de prilocaïne
- Chlorhydrate de prilocaïne
- Solution injectable hyperbare
- Boîte de 10 ampoules de 5 ml
Commercialisé en août 2014.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments, accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/62999444/extrait
Notice
Résumé des caractéristiques du produit
Avis de la commission de la transparence
Trasylol® 500 000 UIK/50 ml, solution injectable / DCI* : aprotinine
Trasylol® 500 000 UIK/50 ml, solution injectable / DCI* : aprotinine
- Aprotinine
- Boîte de 1 flacon de 50 ml
Commercialisé en janvier 2018.
Informations sur le produit
Les documents ci-dessous sont disponibles sur le site de la base de données publique des médicaments, accessible via le lien suivant :
https://base-donnees-publique.medicaments.gouv.fr/medicament/65436166/extrait
Notice
Résumé des caractéristiques du produit
Avis de la commission de la transparence
Consultez également :
Document de mesure additionnelle de réduction des risques
Guide professionnels de santé
Ophtalmologie
LACRIFILL®, gel canaliculaire Seringue à usage unique - gel d'acide Hyaluronique 20 mg/ml
LACRIFILL®, gel canaliculaire
Seringue à usage unique – gel d’acide Hyaluronique 20 mg/ml
-
Gel stérile d’acide Hyaluronique hautement réticulé à 20 mg/ml
-
Indiqué pour le traitement de la sécheresse oculaire
-
Seringue à usage unique pour administration dans les méats lacrymaux
-
Mise à disposition à partir de janvier 2026
-
Boite de 10 seringues

Informations sur le produit
La notice est disponible via le lien suivant : https://www.nordicpharma.fr/wp-content/uploads/sites/22/2025/10/LACRIFILL-NOTICE.pdf
Nordic Pharma est adhérent des éco-organismes CYCLAMED et DASTRI
Déposez vos médicaments non utilisés, périmés ou non, en pharmacie. En savoir plus sur la collecte sur www.cyclamed.org
Déposez vos objets perforants (seringues, stylos…) dans les boîtes à aiguilles disponibles en pharmacie. En savoir plus sur la collecte sur www.dastri.fr
Caractéristiques environnementales des produits Nordic Pharma
La loi Anti-Gaspillage pour une Économie Circulaire (loi AGEC) vise à mieux informer le consommateur, à renforcer la prévention des déchets et à favoriser le recyclage des produits en fin de vie.
En application de cette loi, nous mettons à disposition une information sur les caractéristiques environnementales des produits commercialisés par Nordic Pharma.

Et le tri ?
Découvrez toutes les consignes de tri et les lieux de collecte près de chez vous sur www.consignesdetri.fr
* DCI : Dénomination Commune Internationale
Si vous souhaitez signaler un effet indésirable, cliquez ici
Notre Démarche Qualité


